Bulletin N°37

La repopulation du SNC par des cellules microgliales-like d'origine hématopoïétique corrige la déficience en progranuline chez la souris - Nature Communications – Juillet 2024
La transplantation de cellules souches hématopoïétiques permet de générer des cellules microgliales-like qui peuvent délivrer des protéines thérapeutiques au sein du système nerveux central (SNC). Cependant, les approches actuelles de conditionnement pré-greffe (= traitement du receveur permettant une meilleure prise de greffe) n’autorisent qu’un remplacement faible et lent des cellules microgliales natives. Dans cette étude, les auteurs ont expérimenté un nouveau protocole de conditionnement qui permet un remplacement rapide, robuste et persistant des cellules microglies, sans effets indésirables sur les plans neurobiologique et de l'hématopoïèse. Ce protocole combine la myéloablation au busulfan et un traitement de 6 jours par PLX3397 (Pexidartinib), un inhibiteur pharmacologique de CSF1R. Les analyses par RNA-seq sur cellule unique (« single-cell RNA-seq ») montrent que dans le SNC, la plupart des cellules dérivant du greffon exprimant des gènes caractéristiques des cellules microgliales homéostatiques ou des macrophages associés au SNC (macrophages méningés, des espaces périvasculaires et des plexus choroïdes). On observe dans le SNC une induction transitoire de cytokines myéloprolifératives et chimiotactiques qui facilitent le repeuplement microglial. Chez des souris déficientes en progranuline (PGRN), ce protocole permet de restaurer l’expression microgliale de PGRN dans le cerveau et la rétine, de diminuer l’accumulation de grains de lipofuscine et de normaliser la protéostase et le métabolisme lipidique.

Les interactions APOE4-neutrophiles-microglie dépendantes du sexe sont responsables des troubles cognitifs dans la maladie d'Alzheimer - Nature Medicine – Juillet 2024
L'APOE4 est le plus important facteur génétique de susceptibilité à la maladie d'Alzheimer (MA), notamment chez les sujet de sexe féminin. Dans cette étude, les auteurs ont réalisé une analyse par RNA-seq sur cellule unique (« single-cell RNA-seq ») et cytométrie de flux sur les cellules cérébrales et sanguines d’une large cohorte de patients MA porteurs de différents haplotypes APOE. Les résultats obtenus ont ensuite été validés sur deux cohortes indépendantes de patientes atteintes de MA et porteuses APOE4. Les auteurs montrent que la déficience cognitive est associée à l’interaction cellulaire et moléculaire entre neutrophiles et cellules microgliales. Cette interaction est caractérisée par l’induction transcriptomiques de réseaux de co-expression génique (modules de gènes) associés à l’IL-17 et l'IL-1 dans les neutrophiles sanguins et les cellules microgliales. Les neutrophiles IL-17+ chez les patientes APOE4 régulent à la hausse les cytokines immunosuppressives IL-10 et TGF-β et les molécules de point de contrôle immunitaire (« immune checkpoint »), notamment LAG3 et PD-1, associées à un vieillissement immunitaire accéléré. Dans un modèle murin de MA, la suppression d'APOE4 dans les neutrophiles régule négativement ce phénotype immunosuppressif, rétabli la réponse microgliale à la neurodégénérescence et limite la pathologie liée aux plaques amyloïdes. Au plan mécanistique, les auteurs montrent que l’APOE4 régule à la hausse l'IL-17F dans les neutrophiles et que l’IL-17F, en interagissant avec le récepteur IL-17RA sur les cellules microgliales, inhibe l'induction d’un phénotype microgliale protecteur.
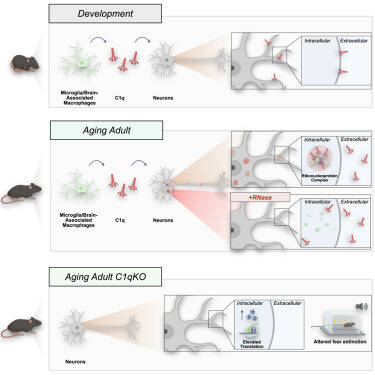
Le C1q dérivé des cellules microgliales s'intègre dans les complexes ribonucléoprotéiques neuronaux et impacte l'homéostasie des protéines dans le cerveau vieillissant - Cell – Juin 2024
La protéine du complément C1q contribue à l'élimination microgliale des synapses durant le développement et dans différents modèles de maladies neurologiques. Dans cette étude, les auteurs montrent que C1q interagit avec les complexes ribonucléoprotéiques (RNP) neuronaux, de manière dépendante de l'âge. In vitro, la protéine C1q purifiée est sujette à un processus ARN-dépendant de séparation de phase liquide-liquide (« liquid-liquid phase separation »). In vivo, l'interaction de C1q avec les complexes RNP neuronaux est dépendante de l'ARN et de l'endocytose. Enfin, les souris âgées dépourvues de C1q présentent des troubles de la mémoire et des altérations neuronales de la synthèse protéique.

L’administration d’un agoniste pharmacologique de STING, la molécule 8803, permet de reprogrammer le microenvironnement immunitaire et d’augmenter la survie dans différents modèles précliniques de glioblastome - Journal of Clinical Investigation – Juin 20
Dans cette étude, l'immunofluorescence séquentielle multiplexe (SeqIF) et l’analyse de l’atlas d’expression génomique « Ivy Glioblastoma Atlas », a mis en évidence l'expression de STING dans les populations myéloïdes infiltrantes et l'espace périvasculaire chez les patients porteurs de glioblastome. Les auteurs montrent ensuite que l’administration de la molécule IACS-8803 (8803), un agoniste de STING, augmente la survie médiane dans plusieurs modèles précliniques de glioblastome. De plus, dans le modèle induit par la lignée QPP8, modèles qui est résistant au blocage des points de contrôle immunitaire (« immune checkpoint inhibitors »), 100 % des souris ont été guéries par le composé 8803. Le profilage phénotypique par cytométrie en flux ex vivo, pendant la fenêtre thérapeutique, a démontré une augmentation du trafic et de l'activation des cellules myéloïdes tumorales, ainsi qu'une amélioration des réponses effectrices des cellules T CD8+ et NK (« Natural Killer »). La molécule 8803 reprogramme les cellules microgliales en induisant les molécules de costimulation CD80/CD86 et l’enzyme oxyde nitrique synthase (iNOS) et en régulant à la baisse les marqueurs d’immunosuppression CD206 et arginase. Chez des souris humanisées, les effets thérapeutiques de 8803 ont été maintenus malgré l’existence d’un silencing épigénétique de STING dans les cellules tumorales humaines. Ce résultat atteste que l’effet thérapeutique du composé 8803 s’exerce essentiellement via la reprogrammation des cellules myéloïdes de l’environnement tumoral. Enfin, bien que la combinaison avec un inhibiteur de STAT3 n'ait pas amélioré l'activité de la molécule 8803, l'ajout d'anticorps anti-PD-1 a augmenté la survie dans un modèle de gliome sensible au blocage des points de contrôle immunitaire.

L'activation des lymphocytes T et l'ARN viral persistent dans les tissus jusqu'à 2 ans après l'infection par le SARS-CoV-2 - Science Translational Medicine – Juillet 2024
Les mécanismes physiopathologiques du COVID long sont encore mal compris. Un nombre croissant de données indiquent que la persistance virale et les anomalies du système de régulation immunitaire, notamment la dysfonction des lymphocytes T, peuvent y jouer des rôles majeurs. Dans cette étude, les auteurs ont effectué des examens d'imagerie corps entier par tomographie par émission de positons sur une cohorte bien caractérisée de 24 patients atteints de COVID, sur une période s’étalant de 27 à 910 jours après l'infection aiguë par le SARS-CoV-2. L'agent radiopharmaceutique F-AraG, a été utilisé comme traceur sélectif permettant la détection et la quantification des lymphocytes T activés. Par rapport aux contrôles prépandémiques, la captation du traceur dans le groupe des patients COVID, qu’ils présentent ou non des symptômes persistants, était plus élevée dans de nombreuses régions, y compris le tronc cérébral, la moelle épinière, la moelle osseuse, les tissus lymphoïdes nasopharyngés et hilaires, les tissus cardiopulmonaires et la paroi intestinale. L'activation des lymphocytes T dans la moelle épinière et la paroi intestinale était associée à la présence de symptômes de COVID long. De plus, la captation du traceur dans le tissu pulmonaire était plus élevée chez les patients présentant spécifiquement des symptômes pulmonaires persistants. Toutefois, une activation accrue des lymphocytes T dans ces tissus a également été observée chez de nombreux sujets ne présentant pas de COVID long. Étant donné la forte captation de F-AraG détectée dans l'intestin, les auteurs ont étudié ex vivo les tissus colorectaux de 5 patients souffrant de COVID long. Les analyses par hybridation in situ et immunohistochimie ont démontré la persistance d'ARN et de protéines du SARS-CoV-2. En particulier, l'ARN simple brin intracellulaire du SARS-CoV-2 codant la protéine spike a été observé dans le chorion (lamina propria) de la muqueuse rectosigmoïde chez les 5 patients étudiés. L’ARN double brin codant la protéine spike a été identifié chez trois de ces 5 patients. Ces observations ont été réalisées sur des prélèvements obtenus jusqu'à 676 jours après l’infection aigue initiale. L’ensemble de ces résultats suggère que chez les patients atteints de COVID long, la persistance virale dans les tissus pourrait être associée à des perturbations immunologiques à long terme.
Les brèves du Bulletin N°37
Article N°1
La stimulation par ultrasons pulsés de faible intensité (LIPUS) module l'activation microgliale après l'implantation de microélectrodes intracorticales.
Nature Communications – Juin 2024
Article N°2
Antonia Wallrapp et Isaac M. Chiu
Article de revue – Les interactions neuroimmunes dans l’intestin.
Annual Review of Immunology – Juin 2024